Dalle piretrine ai piretroidi: introduzione e storia.
Da sempre gli esseri umani sono alla ricerca di insetticidi che abbiano un’elevata tossicità contro gli insetti e contemporaneamente siano innocui verso loro stessi e i mammiferi in genere. In realtà, Piretrine e Piretroidi sono, rispettivamente, le versioni naturali e sintetiche di insetticidi basati su molecole costruite a partire dall’acido ciclopropancarbossilico. Sicuramente per tantissimo tempo le Piretrine naturali hanno rappresentato l’insetticida ideale. Esse erano usate soprattutto con le polveri ricavate dai fiori essiccati [Tanacetum cinerariifolium o piretro della Dalmazia / Chrysanthemum cenerariaefolium]. Durante il periodo antecedente la scoperta dei piretroidi (piretrine di sintesi), il loro utilizzo come ingredienti nelle formulazioni zanzarifughe ha portato a un notevole miglioramento nel “comfort” domestico.
Dalla metà del secolo scorso, la scoperta e la produzione d’insetticidi aventi struttura chimica molto simile a quella delle piretrine ha portato un notevole contributo verso il miglioramento della salute pubblica. Certamente i Piretroidi sintetici hanno ora nel mondo un impatto molto superiore a quello delle Piretrine naturali.
La chimica alla base delle Piretrine e dei Piretroidi.
Per primi, nel 1924, Hermann Staudinger, Leopold.Ružička e collaboratori pubblicarono uno studio fondamentale sulle piretrine naturali ed esse si rivelarono essere una miscela di sei esteri. Questi esteri sono formati mediante la combinazione di due acidi e tre alcoli, da cui 2×3 = 6 esteri.
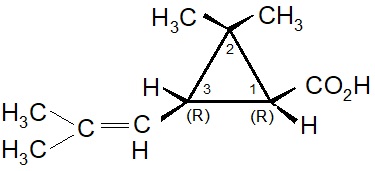
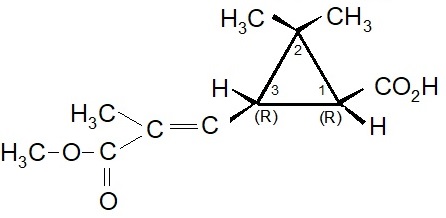
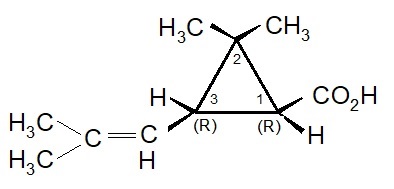
I due acidi: Crisantemico e Piretrico.
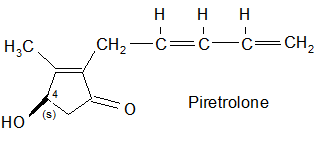
… e i tre alcoli (tipo Rethrolone): Piretrolone, Cinerolone e Jasmolone.
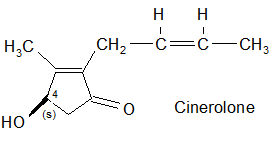
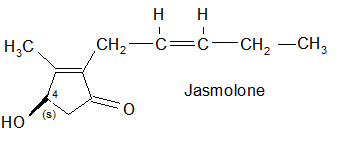
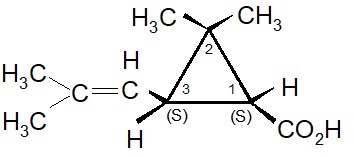
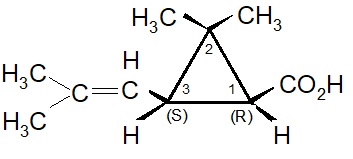
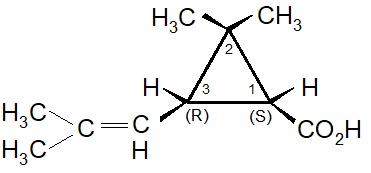
La selezione naturale degli isomeri nelle piretrine.
Matematicamente il numero degli esteri ricavabili dalle molecole sopracitate sarebbe molto elevato: infatti sono possibili 4 isomeri per l’acido crisantemico, 8 per l’acido piretrico e 12 in totale per i 3 alcooli. In realtà i sei esteri presenti nell’estratto dai fiori del piretro Chrysanthemum cenerariaefolium contengono solo pochi specifici isomeri. Inoltre è rimarchevole il fatto che che gli isomeri sintetizzati dalla pianta indicata sono quelli maggiormente attivi dal punto di vista biologico e non vi è traccia della presenza degli isomeri meno efficaci. Questo fatto ha indirizzato la ricerca per ottenere insetticidi sintetici.
Gli inizi della ricerca per gli insetticidi sintetici (piretroidi)
I primi tentativi effettuati da Staudinger e Ruzicka, seguiti poi da Campbell e Harper, aprirono la strada per la sintesi chimica dell’acido crisantemico. All’inizio fu ottenuta solo una miscela dei quattro possibili stereoisomeri: d-trans, l-trans, d-cis, l-cis. Questa miscela fu genericamente indicata come acido d-l-cis-trans crisantemico.
Sintesi dell’Alletrina
Quando l’acido di sintesi suddetto reagisce con l’Allethrolone (un alcool del tipo rethrolone esistente nelle due forme isomere d ed l) e avente la seguente struttura:
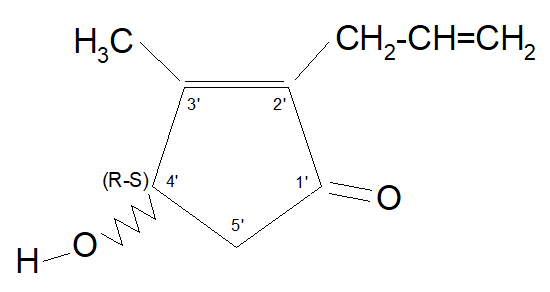
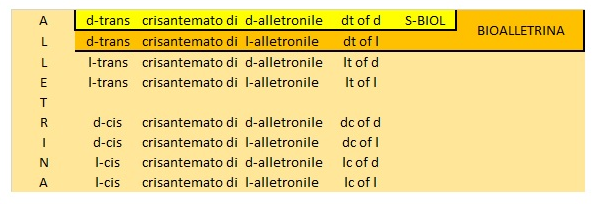
si ottiene una miscela di 4 x 2 = 8 isomeri, alla quale è stato imposto il nome di “Alletrina” o “d-l-cis-trans crisantemato di d-l alletronile“. L’esterificazione dei quattro isomeri dell’acido crisantemico con i due isomeri dell’Alletrolone porta a un piretroide sintetico denominato commercialmente Alletrina. Esso è costituito dalle seguenti otto strutture:
| d-trans crisantemato di d-alletronile – Abbreviato: dt of d | A |
| d-trans crisantemato di l-alletronile – Abbreviato: dt of l | L |
| l-trans crisantemato di d-alletronile – Abbreviato: lt of d | L |
| l-trans crisantemato di l-alletronile – Abbreviato: lt of l | E |
| d-cis crisantemato di d-alletronile – Abbreviato: dc of d | TR |
| d-cis crisantemato di l-alletronile – Abbreviato: dc of l | I |
| l-cis crisantemato di d-alletronile – Abbreviato: lc of d | N |
| l-cis crisantemato di l-alletronile – Abbreviato: lc of l | A |
e la cui rappresentazione geometrica è:
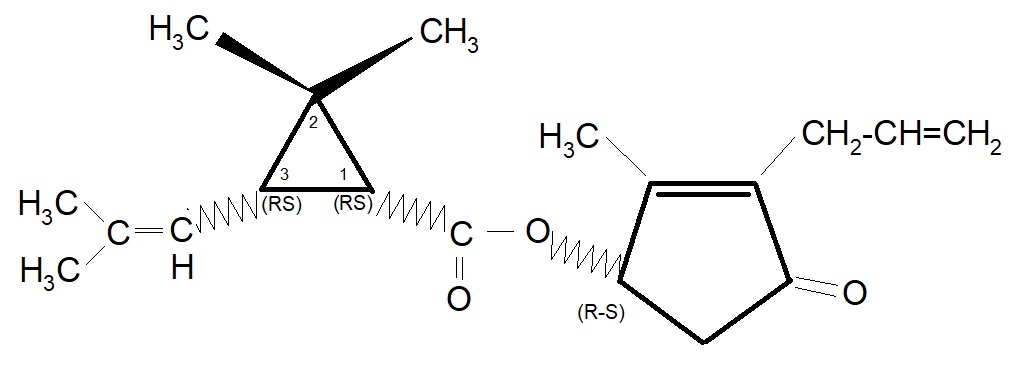
La selezione degli isomeri
Da molto tempo era stato notato che gli isomeri più efficaci sono i due crisantemati di alletronile nella forma d-trans, particolarmente il dt/d. In conseguenza di continue ricerche, nel 1967, J Martel e Ch. Huynh dei laboratori della Rousel-Uclaf scoprirono un nuovo modo di sintetizzare l’acido crisantemico. Questa nuova procedura consentiva di ottenere solo la forma trans. Poi, la successiva scoperta, da parte degli stessi scienziati, della possibilità di separare le forme d-trans e l-trans portò finalmente alla possibilità di ottenere industrialmente l’acido d-trans crisantemico esistente in natura. Di conseguenza questo fatto ha portato alla produzione della Bioalletrina.
Dalla Alletrina alla Bioalletrina
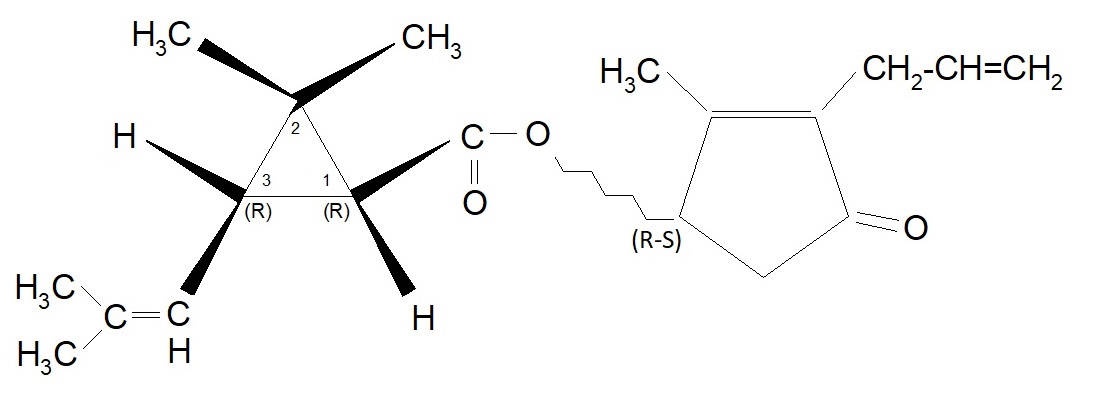
Analogamente alla precedente Alletrina, anche l’acido d-trans crisantemico ottenuto da sintesi chimica fu fatto reagire con il d,l Alletrolone e l’estere risultante fu chiamato Bioalletrina (o più estesamente d-trans crisantemato di d,l Alletronile). La sua formula può essere rappresentata così:
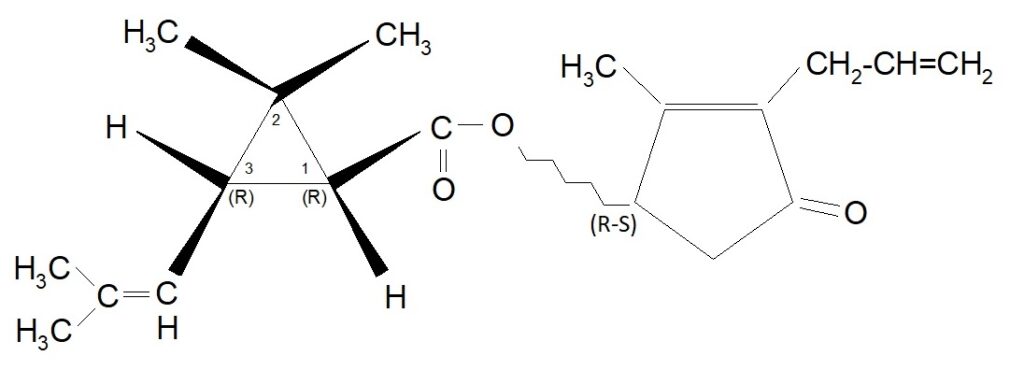
Denominazione proposta dal produttore: -d-trans 2,2 – dimetil – 3 – (2 – metil propenil) ciclopropancarbossilato di d l – 2′ – allil – 4′ idrossi – 3′ metil – 2′ ciclopentene – 1′ – one.
Le prove condotte riguardo l’attività biologica della Bioalletrina rivelarono che essa era pienamente comparabile con quella delle piretrine naturali e ciò indusse a considerare inutile ogni tentativo di sintetizzare queste ultime.
Dalla Bioalletrina all’S-Bioalletrina.
Il passo successivo fu indotto dal fatto che ci si poteva aspettare un ulteriore miglioramento dell’efficacia dell’insetticida se fosse stato possibile separare gli isomeri d ed l dell’Alletrolone e successivamente sintetizzare il d-trans crisantemato di d-Alletronile. Nel 1971 i laboratori della ROUSSELL-UCLAF riuscirono a produrre questa esterificazione e l’isomero puro ottenuto fu denominato S-Bioalletrina. La denominazione commerciale fu ESBIOL o S-Biol. La struttura è la seguente:
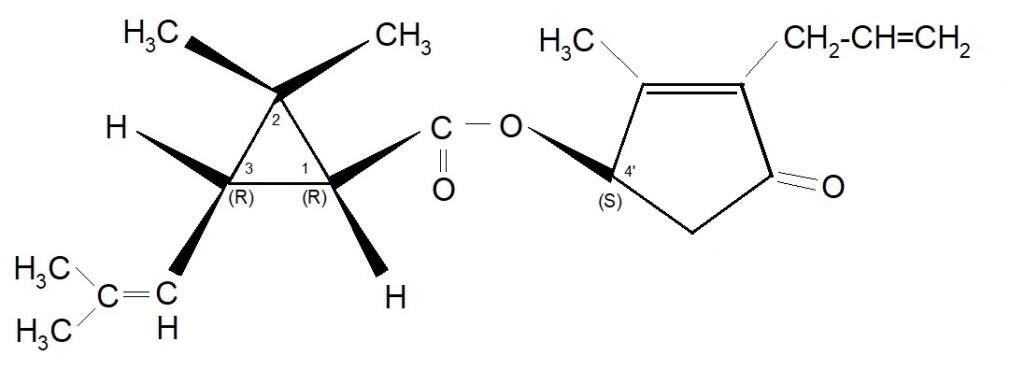
Denominazione proposta dal produttore: -d-trans 2,2 – dimetil – 3 – (2 – metil propenil) ciclopropancarbossilato di d – 2′ – allil – 4′ idrossi – 3′ metil – 2′ ciclopentene – 1′ – one.
Come ci si aspettava, la S-Bioalletrina è tra l’1,75 e 2 volte più attiva della Bioalletrina ed è uno dei più potenti insetticidi dal punto di vista dell’effetto knock-down (formulazioni spray e zampironi).
Variazioni sul tema delle piretrine e dei piretroidi.
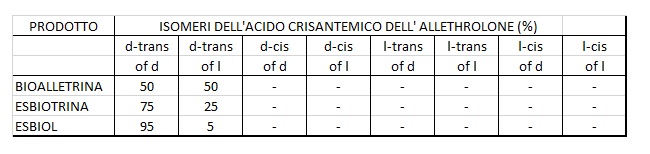
Arrivati a questo punto, la situazione dei piretroidi disponibili presentava questa distribuzione degli isomeri:
Cioè si andava dal dt/d puro ESBIOL (tecnicamente oltre il 95%) al dt/d + dt/l della Bioalletrina con rapporto 50/50 fino all’Alletrina dell’inizio, avente distribuzione 1:1:1:1:1:1:1:1. Con tutta questa disponibilità si è pensato di fare delle miscele d’isomeri ad hoc, per ottenere differenti capacità insetticide e diversi mezzi di diffusione (spirali, tavolette, ricariche con stoppino (wick) poroso (ceramico o composito), spray, eccetera). Tra le varie possibilità si sono affermati tre prodotti: l’ESBIOTRINA, l’ALLETHRINS (o PYNAMIN) e la D-ALLETHRIN (o PYNAMIN FORTE). Tra i produttori, si possono citare ENDURA e SUMITOMO.
ESBIOTRINA
Questo prodotto è praticamente una miscela di Bioalletrina ed S-Biol, in quanto la concentrazione degli isomeri si situa a metà strada:
PYNAMIN e PYNAMIN FORTE.
In questi due prodotti si hanno quantità rilevanti anche degli altri isomeri dell’Alletrina:
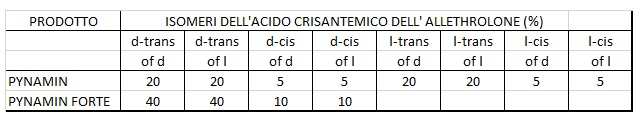
Certamente è interessante notare che “PYNAMIN” è il sinonimo di “ALLETHRINS” mentre “PINAMIN FORTE” è quello di “D-ALLETHRIN”, con esplicito riferimento all’assenza di isomeri “L”. A questo punto, esaurita la varietà dei semplici composti iniziali, è iniziata la ricerca con modifiche chimiche, dapprima all’alcool e poi all’acido. Ci limiteremo alle prime modifiche all’alcool, in quanto gli insetticidi ottenuti sono ancora molto simili ai loro progenitori.
Pynamin Forte: (RS)-3-Allyl-2-methyl-4-oxocyclopent-2- enyl-(1R,3R;1R,3S)-2,2-dimethyl-3-(2- methylprop-1-enyl)-cyclopropanecarboxy late (mixture of 4 isomers 1R trans, 1R:1R trans, 1S: 1R cis, 1R: 1R cis,1S 4:4:1:1) (d-Allethrin) – IUPAC name: Pynamin forte
Modifiche all’alcool: dalla Resmetrina alla Bioresmetrina.
Mentre J. Martel e Ch. Huynh riuscivano a sintetizzare l’acido d-trans crisantemico, Elliott e collaboratori studiavano la possibilità di sintetizzare nuovi alcoli che potessero portare a insetticidi più potenti di quelli con i retroloni utilizzati. Volendo combinare un ciclo attivante con catene insature, Elliott dapprima sviluppò il 2,6 dimetil – 4 allil – benzil – alcool:
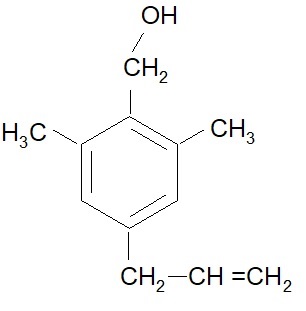
ma dopo di esso fu scelto un ciclo furanico, perché più similare al ciclopentenolo esistente in natura. Questa scelta riscosse un maggior successo e in conclusione si optò per la sintesi del 5-benzil-3-furil-metanolo:
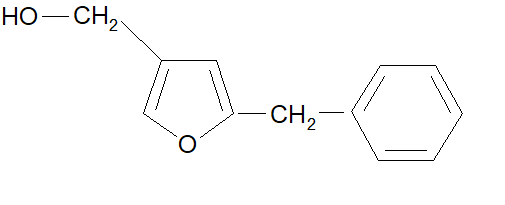
La Resmetrina
Queste innovazioni ebbero un grande significato,in quanto gli esteri ottenuto dalla reazione dei quattro isomeri dell’acido crisantemico con l’alcool sopra descritto denotarono un’intensa attività biologica. La loro miscela può essere descritta dalla seguente struttura:
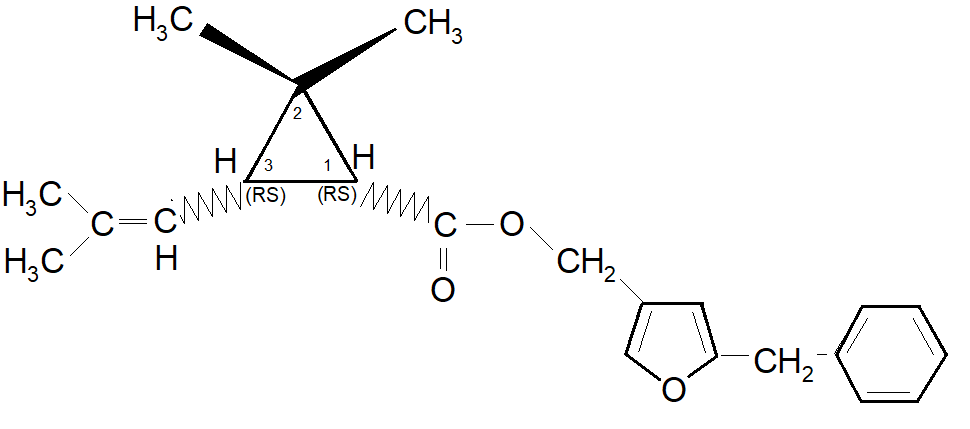
Il prodotto dell’esterificazione del d-l-cis-trans Acido Crisantemico con l’alcool di Elliott fu denominato NRDC 104 o Resmetrina .
Bioresmetrina.
Come si può pensare, il passo successivo è stata l’esterificazione dell’isomero puro dell’acido d-trans crisantemico, da parte della ROUSSEL-UCLAF. Esso ricevette il nome NRDC107 o Bioresmetrina .
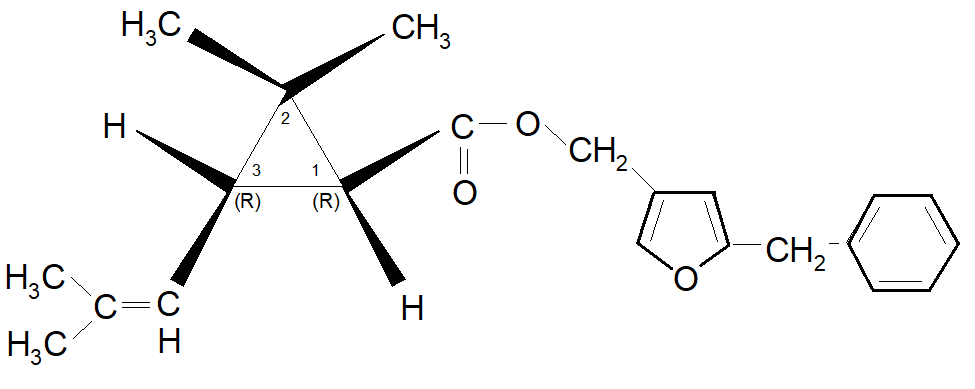
In conclusione si può affermare che la fondamentale scoperta del modo di ottenere l’acido d-trans crisantemico ha notevolmente aumentato l’importanza della sintesi dell’alletrolone e dell’alcool benzil-furil-metilico.
Il considerevole miglioramento dell’attività biologica e del quadro tossicologico dovuto alla combinazione di acido puro d-trans crisantemico (il solo presente in natura al posto della miscela racemica d-l-cis-trans) si riflette in modo analogo nelle serie dell’alletrolone e dell’alcool benzil-furil-metilico.
Effetto Knock-down relativamente a Piretrine e Piretroidi.
Tuttavia, nel caso dei prodotti con l’alletrolone (sia l’estere con il d-l alletrolone che ancor di più con il d-alletrolone) il punto focale di questo miglioramento risiede essenzialmente nel più rapido effetto “Knock-down”. Esso è definito come lo stato di intossicazione e paralisi parziale che di solito precede la morte. Gli insetticidi piretroidi provocano il knockdown in pochi minuti, contrariamente all’azione più lenta di altri gruppi di composti. Inolte, altri fattori che influenzano il Knock-down possono essere le dimensioni delle goccioline spray, l’interazione con sinergizzanti (tipo il piperonil-butossido), l’uso di solvento organici, la velocità di evaporazione della miscela insetticida, eccetera.
Invece, nel caso dell’alcool benzil-furil-metilico, il miglioramento è avvertito essenzialmente nel potere abbattente verso gli insetti.
E’ quindi comprensibile come la variazione percentuale delle miscele di Bioalletrina, S-Bioalletrina e NRDC107 permetta di bilanciare adeguatamente le prestazioni dell’insetticida in termini di effetto “knock-down” e potere abbattente, mantenendo sempre una bassissima tossicità per i mammiferi in genere.
Gli sviluppi successivi hanno portato all’aggiunta di gruppi funzionali come alogeni, -CN, radicali insaturi, eccetera. Sono state prodotte più di quaranta molecole, ognuna con proprie caratteristiche ben definite Ciononostante, le Piretrine e i Piretrodi sono tutt’ora impiegati utilmente per le loro caratteristiche.
Link utili:
https://echa.europa.eu/it/substance-information/
https://echa.europa.eu/it/substance-information/-/substanceinfo/100.044.542
https://echa.europa.eu/it/substance-information/-/substanceinfo/100.044.542
https://echa.europa.eu/it/substance-information/-/substanceinfo/100.030.842
https://echa.europa.eu/it/substance-information/-/substanceinfo/100.044.543
http://pmep.cce.cornell.edu/profiles/extoxnet/24d-captan/allethrin-ext.html
Una biblioteca disponibile:
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/allethrins
Autore: R. Bigoni Ultimo aggiornamento: 5 settembre 2020